| Dictionnaire médical |
Abréviations S Sac Sacc Sacchar Sacr Sain Salm Salmonell Salp Salping San Sana Sang Sani Saph Sarc Scap Scapul Scar Schi Schist Schiz Scia Scie Science Scin Scint Scis Sclé Sclér Scol Scolio Scop Scot Seb Sebo Segm Segment Sept Septic Shif Sial Sibu Sidé Sidéro Sigmoïd Sign Signe de Sinu Sinus Siro Siru Sixi Soci Sodi Solu Solv Soma Somato Somi Soph Soud Sous Span Spas Spasm Spec Sper Sperm Sphi Sphinctér Sphy Sphygm Sphè Sphé Spin Spir Spiro Spla Splanchno Splé Splén Spon Spondyl Stad Stag Stap Staphyl Stapéd Stas Stat Sten Ster Sterco Stom Stre Strepto Stro Stéa Stéat Stén Sténo Stér Stéril Stérol Stéroïd Stéréo Sub Subi Subl Subs Suc Sudo Sudor Sueu Sueur Sui Suic Sulc Suns Supe Supr Supra Sur Sura Surc Surd Surf Suri Surj Surn Suro Surp Surr Surs Sus Sym Symb Symp Sympath Syn Syna Sync Synd Syndesm Syndrome Syne Syno Synovi Synt Syné Syph Syphil Syri Syring Syst Séba Sébo Sémi Sémio Sémé Séne Sér Séro Séru
| Sérum artificiel | |
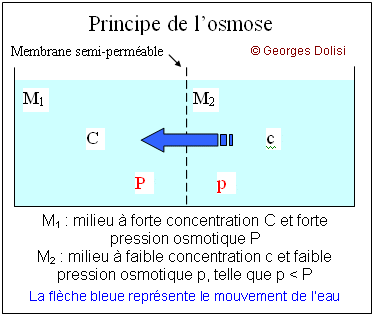
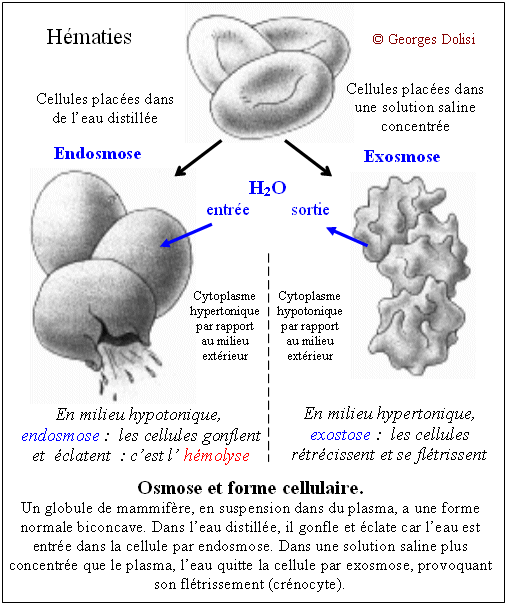
| Médecine hospitalière N. m. * sérum : du latin serum {sér(o)-, séreux, se}, petit-lait ; en physiologie : liquide qui se sépare du sang après coagulation. Le sérum physiologique ou soluté physiologique ou sérum artificiel est une solution isotonique (*) stérile, utilisée généralement en injection intraveineuse, et est le plus souvent à base de chlorure de sodium (Na Cl - sérum salé), parfois de glucose (C6H12O6 - sérum glucosé) ou de bicarbonate de calcium (Ca(CO3)2 - sérum bicarbonaté). Il permet la réhydratation d'un patient, mais il est aussi utilisé comme solvant pour de nombreux médicaments, voire des molécules alimentaires (acides aminés par exemple). La concentration d'un soluté physiologique est en principe voisine de 9g/litre d'eau, correspondant aux 6g/L de chlorure de sodium du plasma et 3g/L pour les autres sels dissous. (*) Isotonique : * iso : du grec isos [iso], égal ; * tonie : du grec tonos [ton(o)-, tonie, tonine], tension. L'osmose est le mouvement de l'eau (ou d'un autre solvant) vers une région de plus faible potentiel aqueux, où la concentration des molécules dissoutes ou des ions est plus élevée. Le milieu de plus forte concentration est hypertonique (**) par rapport au milieu de plus faible concentration qui lui est hypotonique. Ce principe de l'osmose doit être respecté dans de nombreux cas : perfusions, concentrations des engrais pour les végétaux ... Dans cet exemple, on parle d'osmonocivité, car l'injection intraveineuse d'un soluté de concentration différente de celle du sérum sanguin provoque une pathologie : l'hémolyse. (**) Hypertonique : * hyper : du grec huper [hyper-], au-dessus (anatomie) ou supérieur à la normale, en intensité ou en quantité ; * tonie : du grec tonos [ton(o)-, tonie, tonine], tension. Cet adjectif qualifie une solution qui exerce une pression osmotique supérieure à celle d'une autre solution. Lorsqu'on met une solution hypertonique en contact avec une solution qui lui est hypotonique par l'intermédiaire d'une membrane biologique (semi-perméable), le fait qu'elle ait une concentration totale plus élevée en substance dissoutes attire par osmose, l'eau de l'autre solution. La solution hypertonique se dilue progressivement, alors que la solution hypotonique perd de l'eau et se concentre. Le phénomène s'arrête lorsque les deux solutions sont isotoniques c'est-à-dire lorsque les pressions osmotiques des deux solutions en contact sont égales. Ce phénomène est très important dans les transfusions par voie intraveineuse : les solutés doivent être isotoniques du plasma. En d'autres termes : la pression osmotique fait passer l'eau du milieu le moins concentré (dont la concentration va de ce fait augmenter) vers le milieu de plus concentré (l'arrivée d'eau fait diminuer sa concentration) jusqu'à ce que les deux milieux soient isotoniques (pressions osmotiques égales).
© Georges Dolisi | |
| < vers le menu principal | Politique de confidentialité | App Privacy Policy | Contact | ^ haut de la page |
| © 2006, 2020 Medicopedia | Powered by JIMaroc |